与药包材变更相关的技术指导原则与要求
作为医药行业来讲,合规始终是第一步。从2015年国家出台《关于改革药品医疗器械审评审批制度的意见》以来,整个中国迎来了各种法规的变化,包含更新,废止,与国际接轨。光是一致性评价,前前后后就出台了许多的法规【参考文献1】。
从去年到今年,关于药品上市后的变更,特别是化药的变更技术指导原则,前前后后征求了不少业内的意见,最终才在2021年尘埃落定。今天,我们就来讲一讲2021年NMPA发布的,三个涉及到药品包装材料变更的文件,与大家共同学习。
今年与包材变更相关的三个文件


今年以来,与包材变更的三个文件是:
已上市化学药品药学变更研究技术指导原则(试行)(2021年第15号)
境外已上市境内未上市化学药品药学研究与评价技术要求(试行)(2021年第21号)
已上市生物制品药学变更研究技术指导原则(试行)(2021年第31号)
我们分别对每一个文件中与包材相关的内容进行截取。
已上市化学药品药学变更研究技术指导原则(试行)



该试行版本于2021年2月10号发布,作为2021年的第15号令,其内容提纲如下:

图1 化药变更指导原则目录
在第9章中,针对变更包装材料与容器,进行了详细的变更分类,可以看到:
微小变更(图2):
微小变更中,“非无菌固体制剂” 的材质/类型变更,是在微小变更中,反过来来说,如果是无菌的固体制剂,液体制剂,这是不适用的,只要有材质/类型的变更,不会在此类别中
微小变更中,“本指导原则中未规定的包装材料与容器的供应商、尺寸/形状的变更”, 这里提了供应商变更,并且相当于开了一道口子,比如说,都是玻璃包装材料(尽管不同厂家的玻璃材质肯定有所不同),从A家切换至B家,并且不是在微小变更中的提到的情况,还是有可能在微小变更里面的,这可以基于风险评估及数据来说明。


图2 已上市化药微小变更的内容
中等变更(图3):
中等变更中,“变更非无菌 固 体制剂 的包装材料和容器 的材质和 或 类型的下列情形:如, 泡 罩包装、瓶装、袋装等之 间 的变更,双铝泡罩变更为铝塑泡罩 等 ”属于中等变更,也就是说,并非“所有非无菌制剂的材质类型变化,都是微小”
)中等变更中,非常明确,提到:变更注射剂的 包装材料和容器的供应商、尺寸 和 或 形状, 也就是说,换供应商,就是定位成中等,如果说还涉及到材质的变化,那只能再提高变更等级
这一点,对于药品企业是非常关键的,基本就按照下面图4规定的研究验证工作,照着来进行;如果涉及密封件的,还要进行CCIT的研究。


图3 已上市化药中等变更的内容
重大变更(图4):
重大变更中,明确了,变更注射剂的材质与类型,是重大变更,包括跨材料(玻璃变塑料),跨类型(三层膜变五层膜等)
重大变更中,还有一个值得注意的是,如果变更后的包装材料与容器,登记号为“I”的话,那就是重大变更。这是什么意思呢?就是说,如果出现一个状态为“I”的包材,药厂可能就会多考虑一下,因为要做的研究会多一些。反过来讲,如果该状态为“A”,那可以按照中等变更来执行。这也是鼓励广大的包材厂商,赶紧给“A”了,这样制剂企业会更加愿意选择你。


图4 已上市化药重大变更的内容
境外已上市境内未上市化学药品药学研究与评价技术要求


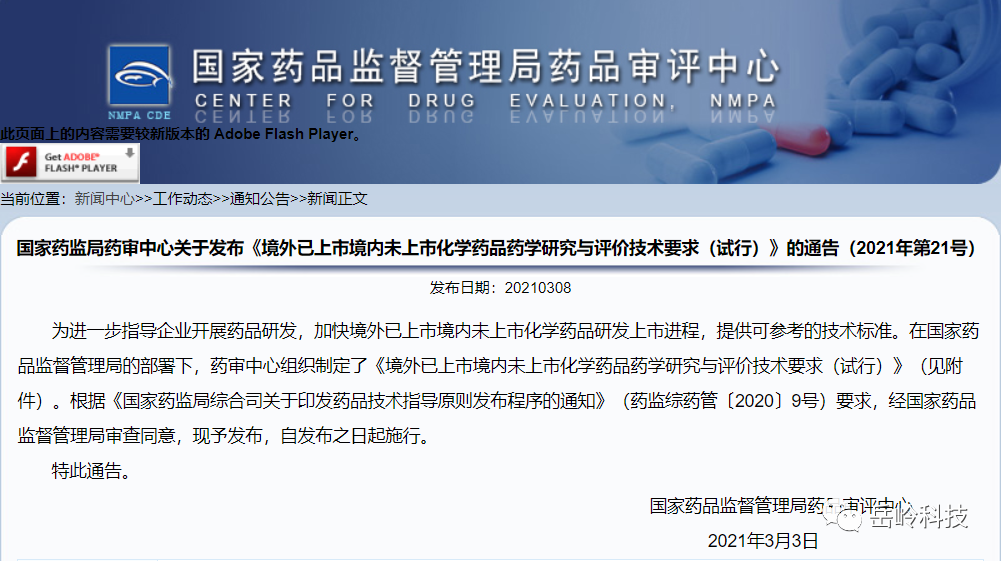
该要求针对的是境外已上市境内未上市的药学研究要求,内容很简单,直接贴了;在执行层面,还是需要去参照“相关的”指导原则。

图5 境外已上市境内未上市的包材要求
已上市生物制品药学变更研究技术指导原则(试行)



里面涵盖了如下章节:

图6 生物制剂变更指导原则目录
在这些章节中,与包装材料相关的(二)(五) 与(五)(二)相关。内容如下,相比化药的变更指导原则,这里比较好的是,在一张表中把不同的变更类型进行了分类(满足前提条件后),并且需要做的事(技术要求)也列出来。
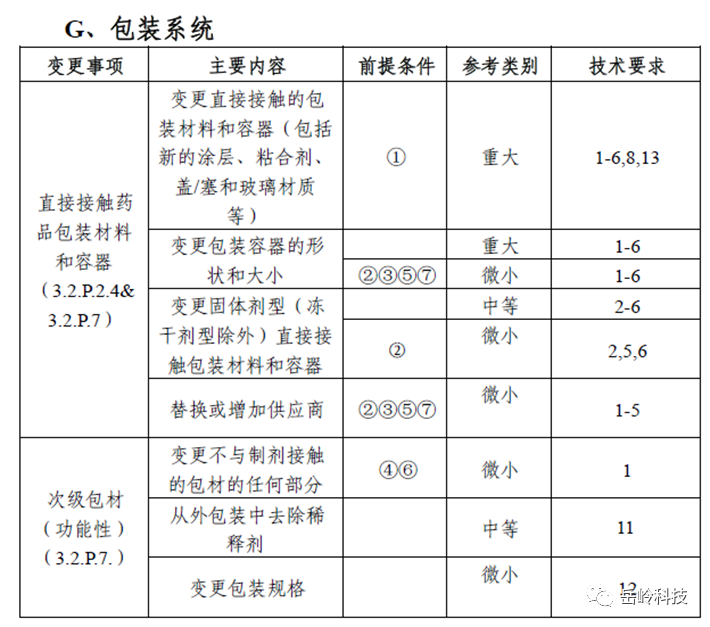
图7 变更分类表
这里的1-7的前提条件如下:

图8 变更评定时的前提条件
这里我们重点看看供应商变更“替换或增加供应商”,可以看到,如果为改变材质与类型,并且直接接触药品的材料,形状等未变化或者等效;同时不影响稳定性;登记号为A,那就可以定为微小变更。虽然定为微小,实际上,要做的事情,并不少,需要完成1-5的工作。

所以,按照该说法,如果在变更供应商时,如果无法满足微小变更的前提,那就往上升高等级;如果无法满足,那就再上一级,那就按照重大变更的要求来进行。最差的情况,按照1-6,8,13的要求来进行。
今天就分享到这,给大家简单介绍了三个与包材变更相关的情况。
参考文献:
1.2021-02-10: 已上市化学药品药学变更研究技术指导原则(试行)(2021年第15号)
2. 2021-03-08:境外已上市境内未上市化学药品药学研究与评价技术要求(试行)(2021年第21号)
3. 2021-06-25: 已上市生物制品药学变更研究技术指导原则(试行)(2021年第31号)
